Química: Configuración electrónica Guía de temas para el examen IPN
La Química es una ciencia que está presente en diversas áreas de la vida cotidiana y que se involucra con muchas otras ciencias, como la Física, la Biología, la Medicina o la Geología, y es debido a esto, que todos tenemos que estudiar un poco de Química, aunque no vayamos a cursar alguna carrera directamente relacionada con esta.
Unitips te explica sobre los principales temas de estudio. En esta ocasión te explicaremos un tema que es parte de la guía del IPN y que probablemente esté presente en el examen de admisión: La Configuración Electrónica.
En caso de que seas un visitante ocasional a nuestro blog, te decimos que somos una plataforma de cursos de admisión a la Universidad y nos dedicamos a apoyar a los alumnos de bachillerato y de universidad a conocer temas de importancia para tu preparación para el examen de ingreso o bien, para que logres aprender los temas mas importantes de estudio de manera muy sencilla y divertida.
En el examen de ingreso al IPN, es muy probable que te pregunten por la configuración electrónica de los elementos, además, si vas a estudiar una carrera relacionada con la Química, seguro lo volverás a ver. Es un tema muy interesante; ya que nos permite entender cómo está constituida la materia y en especial, ahorita, te servirá para pasar el examen de admisión del IPN.
La configuración electrónica es la manera en que los electrones están ordenados y distribuidos en los distintos orbitales atómicos. Esta configuración viene dada por un modelo atómico resultante de las teorías de Schrödinger y de Heisenberg.
Para realizar la configuración electrónica es necesario:
1.- Conocer el número de electrones que tiene un átomo, este número es igual al número de protones, por lo que el número atómico, nos dice cuántos electrones tiene un átomo.
2.- Identificar el tipo de orbitales que existen, estos pueden ser s, p, d y f, y de acuerdo con el principio de exclusión de Pauli, cada orbital puede tener solo dos electrones. Además, en cada nivel hay, un orbital s, tres p, cinco d y siete f.
3.- Hacer la distribución de electrones en cada nivel y orbital, utilizando el diagrama de Moeller, en orden diagonal, llamada Regla de Madelung, como se ve en la siguiente imagen.

Estructura para el examen de admisión al IPN
Siguiendo estos pasos, es posible ubicar a cualquier elemento en la familia y el periodo al que pertenece. Veamos un ejemplo a través de la configuración electrónica del Fósforo, este átomo tiene un número atómico de 15, por lo que ese es el número de electrones que posee, así que se llenan los orbitales hasta llegar a los 15 electrones.

Se analizan los electrones de los orbitales que no se llenaron, en este caso están en el nivel 3, además, tiene 3 electrones desapareados, porque el llenado de los orbitales se hace con el llenado de Aufbau, este modelo indica que los orbitales deben llenarse primero con un electrón desapareado, y si hay suficientes electrones, poner el segundo electrón para llenar el orbital como se muestra a continuación:
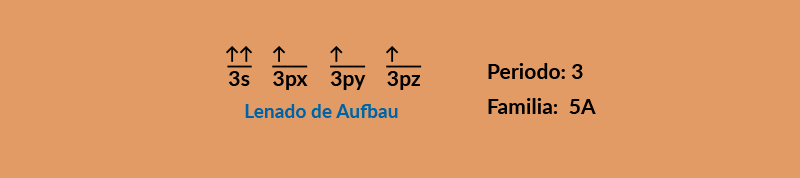
Se ve que sus últimos electrones sólo llegan al nivel 3, lo que indica que esa es su capa de valencia, además tiene 5 electrones en esta capa, por lo que su valencia es de 5, esto significa que este elemento se encuentra en el periodo 3 y en la familia 5A de la tabla periódica.

También es notorio que los electrones desapareados están en el bloque p, por lo que la tabla periódica se puede ver de la siguiente manera:
.png?width=640&name=Captura%20de%20pantalla%20(16).png)
La configuración electrónica de los átomos determina su posición en la tabla periódica, sin embargo, su verdadera utilidad es determinar la reactividad de los elementos, es decir, su capacidad de combinarse. En este caso el Fósforo tiene 3 electrones desapareados que marcan su capacidad de combinarse con otros átomos.
Como pudiste ver, realizar la configuración electrónica de los átomos, no es tan complicado como parece, en un proceso fácil, además aprenderlo muy bien, te servirá para ubicar a cada elemento químico en la tabla periódica, y responder exitosamente algunas de las preguntas de tu examen de admisión al IPN.
Estudia muy bien, este y otros temas que están presentes en la guía del IPN; practica con más ejercicios y verás que no tendrás problemas en tu examen de admisión al IPN.
Unitips te ayuda a prepararte para que en esta convocatoria del IPN 2019, logres obtener un buen resultado para ingresar al IPN.



