Domina este tema de química y quédate en el IPN
A lo largo de la historia el hombre siempre ha intentado descubrir la esencia de las cosas para dar origen a leyes o teorías. La ciencia dio lugar a la explicación de la organización de la materia en términos de las fuerzas que la unen, que ahora conocemos como enlaces químicos y que determinan la interacción entre átomos y moléculas.
El concepto de enlaces y las ordenaciones se los debemos a Gilbert Newton Lewis, y es un tema que posiblemente venga en tu examen de admisión al IPN.
En honor a él, conocemos como estructuras de Lewis al arreglo entre los átomos y los electrones.
Para lograr dominar las estructuras de Lewis en tus clases de Química y en tu examen de admisión al IPN debes tener en cuenta dos cosas: la regla del octeto y la configuración electrónica.
Lewis afirmaba que una capa de valencia compuesta por 8 electrones es especialmente estable y que los átomos transfieren o comparten electrones para alcanzar una estructura electrónica firme. Aunque, no siempre, todos los compuestos estables cumplen con lo que se llama la regla del octeto. Esta regla dice, básicamente, y como ya lo explicamos, que hay que obtener estabilidad energética completando ocho electrones en su última capa, la de valencia. Ojo, esto puede ser una pregunta del examen de admisión al IPN.
Un ejemplo de gases que cumplen la regla del octeto, son los gases nobles, exceptuando al Helio.
Al compartir electrones, los átomos forman enlaces, uniendo los orbitales atómicos que los contienen y formando un enlace sencillo. En ocasiones, los átomos pueden compartir más de un electrón y un par de electrones, por lo que se forma un enlace doble. Al compartir 3 pares de electrones, se forma un enlace triple.
Las estructuras de Lewis se utilizan para representar el ordenamiento electrónico de la capa de valencia en los átomos. Esta representación, a su vez, sirve para conocer la forma en la que se combinan los átomos, en tu examen de admisión al IPN, es probable que te pregunten por la representación de las estructuras de Lewis de algunos compuestos.
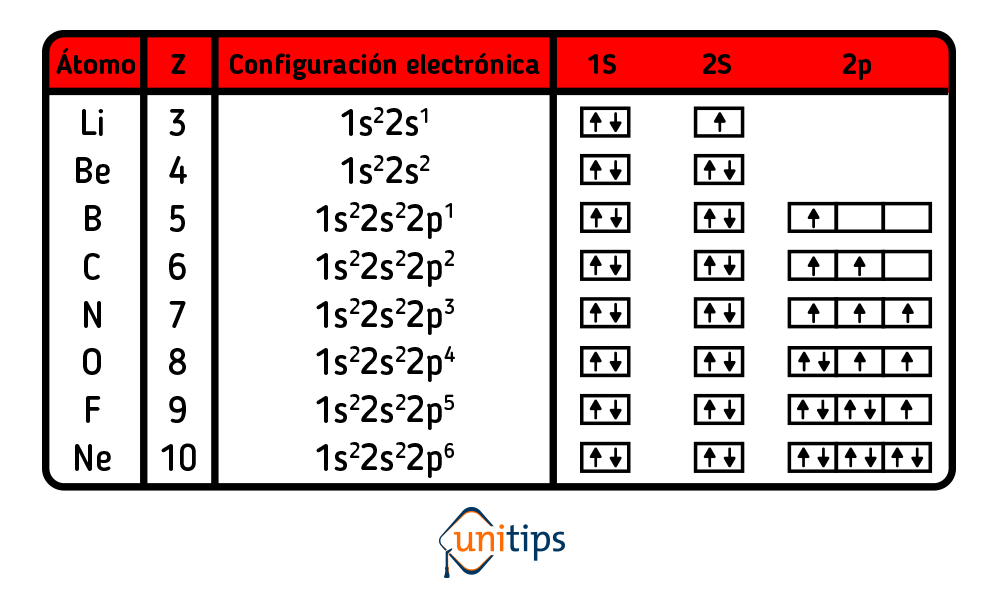
Para comenzar, partimos de la configuración electrónica, en donde podemos ver la cantidad de electrones que tiene un átomo en su capa de valencia, al combinarlo con otros átomos, es necesario hacer uso de los los electrones de valencia en el orden adecuado para determinar la forma de un compuesto.
A continuación te mostramos la configuración electrónica del Litio hasta el Neón, átomo que cumple con la regla del octeto por sí mismo.
Pongamos un ejemplo, veamos la configuración electrónica del Amoniaco, cuya fórmula es NH3, entonces partimos de sus configuraciones electrónicas.
El nitrógeno tiene 7 electrones, por lo que en su capa de valencia tiene 5 electrones, esos 5 electrones son los que pueden combinarse con otros átomos. El hidrógeno por su parte sólo tiene 1 electrón, por lo que este, es el que se usa para formar enlaces. Así, la forma que toma el amoniaco de acuerdo con Lewis es la siguiente:
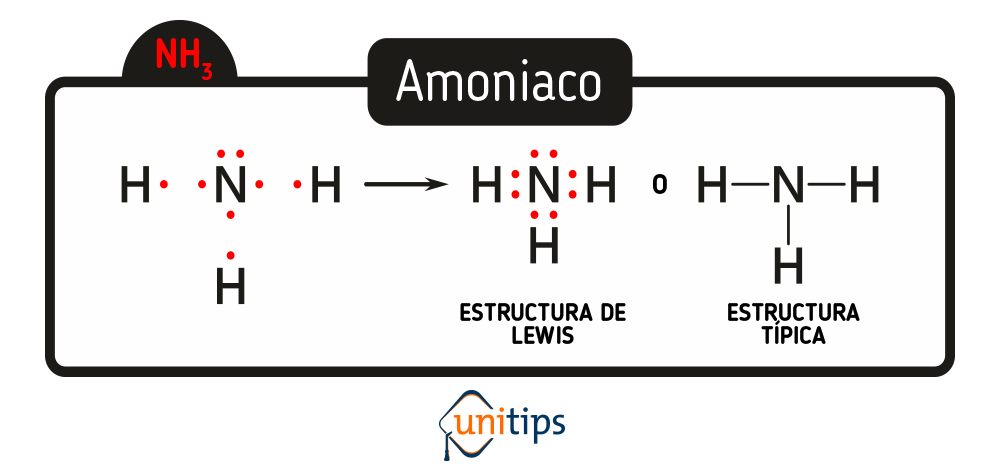
De esta manera, se entiende que el nitrógeno tiene sus 2 electrones apareados en la parte superior, y que además, los electrones desapareados se combinan cada uno con el electrón desapareado del hidrógeno.
Recuerda que esto es tan sólo la introducción al tema de las estructuras de Lewis.





